✅ Balanceá ecuaciones químicas ajustando coeficientes, respetando la conservación de masa y carga. Practicá con reacciones simples y complejas. ¡Descubrí la química!
Para balancear correctamente las ecuaciones químicas, es necesario asegurarse de que la cantidad de átomos de cada elemento sea igual en ambos lados de la ecuación. Esto implica ajustar los coeficientes de los reactivos y productos sin alterar las fórmulas químicas de las sustancias. El principal objetivo es cumplir con la ley de conservación de la masa, que establece que en una reacción química, la masa de los reactivos debe ser igual a la masa de los productos.
El proceso de balanceo de ecuaciones químicas puede parecer complicado al principio, pero siguiendo algunos pasos básicos y teniendo en cuenta algunos consejos prácticos, se puede lograr con facilidad. A continuación, exploraremos el método paso a paso para equilibrar ecuaciones, además de ofrecer ejemplos y recomendaciones que facilitarán tu comprensión y aplicación de esta técnica.
Método paso a paso para balancear ecuaciones químicas
1. Escribe la ecuación no balanceada
Comienza escribiendo la ecuación química en su forma no balanceada. Por ejemplo, para la reacción de combustión del etano (C2H6), la ecuación inicial sería:
C2H6 + O2 → CO2 + H2O
2. Cuenta los átomos de cada elemento
Identifica y cuenta la cantidad de átomos de cada elemento en los reactivos y productos. En nuestro ejemplo:
- C en reactivos: 2 (de C2H6)
- H en reactivos: 6 (de C2H6)
- O en reactivos: 2 (de O2)
- C en productos: 1 (de CO2)
- H en productos: 2 (de H2O)
- O en productos: 3 (1 de CO2 y 2 de H2O)
3. Ajusta los coeficientes
Comienza a ajustar los coeficientes para igualar el número de átomos de cada elemento. Es recomendable empezar por aquellos que aparecen en menor cantidad. En nuestro ejemplo:
- Ajustamos el carbono: 2 CO2 (ahora hay 2 átomos de carbono)
- Ajustamos el hidrógeno: 3 H2O (ahora hay 6 átomos de hidrógeno)
- Por último, ajustamos el oxígeno: 7/2 O2 (ahora hay 7 átomos de oxígeno)
4. Verifica y simplifica
Revisa que todos los elementos estén balanceados. Si hay fracciones en los coeficientes, como en nuestro ejemplo, puedes multiplicar toda la ecuación por 2 para eliminar la fracción:
2 C2H6 + 7 O2 → 4 CO2 + 6 H2O
Ejemplo adicional
Consideremos la reacción de formación del agua:
H2 + O2 → H2O
Siguiendo el mismo método:
- Contamos: H=2 (reactivos), O=2 (reactivos); H=2 (productos), O=1 (productos).
- Ajustamos: 2 H2 + O2 → 2 H2O.
Con estas instrucciones, el balanceo de ecuaciones químicas se vuelve una tarea más accesible. Practicar con diferentes ejemplos ayudará a afianzar este conocimiento y a aplicarlo con confianza en distintas situaciones químicas.
Ejemplos prácticos para equilibrar ecuaciones químicas paso a paso
Equilibrar ecuaciones químicas es fundamental para entender las reacciones químicas. A continuación, presentaremos ejemplos prácticos que ilustran cómo llevar a cabo este proceso de forma sencilla y efectiva.
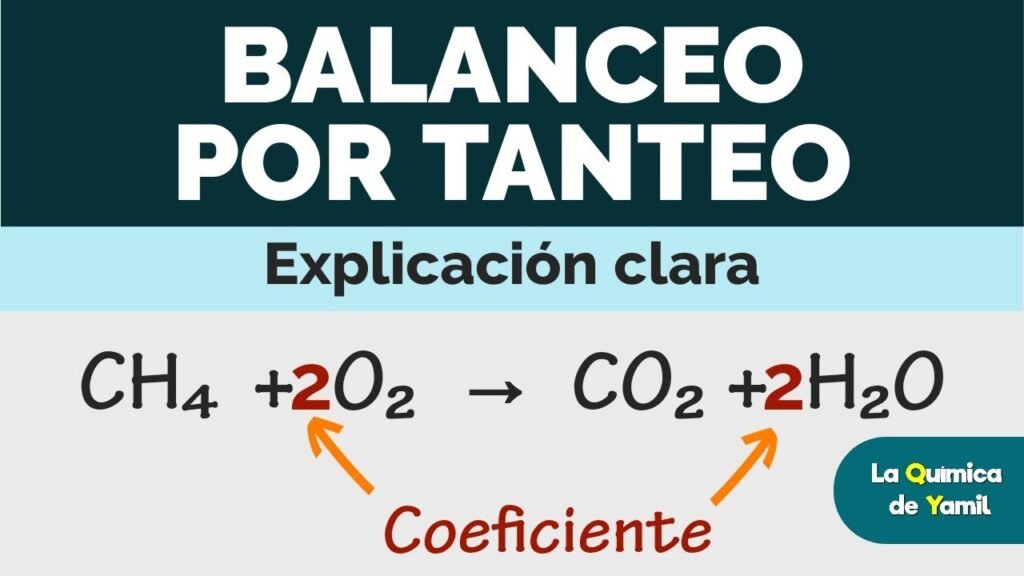
Ejemplo 1: Combustión del Metano
Consideremos la ecuación de la combustión del metano (CH4).
La ecuación no equilibrada es:
CH4 + O2 → CO2 + H2O
- Contar los átomos de cada lado:
- Reactantes: 1 C, 4 H, 2 O
- Productos: 1 C, 2 H, 3 O
- Balancear los átomos de hidrógeno:
- Recontar los átomos:
- Reactantes: 1 C, 4 H, 2 O (de O2)
- Productos: 1 C, 4 H, 4 O (2 de CO2 y 2 de 2 H2O)
- Balancear el oxígeno:
Para equilibrar los 4 átomos de hidrógeno, se añade un coeficiente de 2 frente al agua:
CH4 + O2 → CO2 + 2 H2O
Como hay 4 átomos de oxígeno en los productos, se necesita 2 moléculas de O2 en los reactantes:
CH4 + 2 O2 → CO2 + 2 H2O
Ejemplo 2: Reacción de Neutralización
Veamos también la reacción de neutralización entre ácido clorhídrico y hidróxido de sodio.
La ecuación no equilibrada es:
HCl + NaOH → NaCl + H2O
- Contar los átomos de cada lado:
- Reactantes: 1 H, 1 Cl, 1 Na, 1 O
- Productos: 1 Na, 1 Cl, 2 H, 1 O
- Ya están equilibrados los átomos de Na y Cl, pero hay un desbalance en los átomos de hidrógeno. Se añade un coeficiente de 2 frente al HCl:
2 HCl + NaOH → NaCl + H2O
Consejos prácticos para equilibrar ecuaciones
- Comenzar siempre con los compuestos más complejos.
- Utilizar coeficientes enteros para evitar fracciones.
- Revisar siempre el equilibrio final observando la cantidad de átomos en ambos lados.
- Practicar con diferentes tipos de reacciones, como síntesis y descomposición.
Tabla de comparación de tipos de reacciones
| Tipo de Reacción | Ejemplo | Características |
|---|---|---|
| Síntesis | A + B → AB | Dos o más reactantes se combinan para formar un solo producto. |
| Descomposición | AB → A + B | Un único compuesto se descompone en dos o más productos. |
| Redox | 2 Na + Cl2 → 2 NaCl | Involucra la transferencia de electrones. |
| Neutralización | HCl + NaOH → NaCl + H2O | Ácido y base reaccionan para formar sal y agua. |
Errores comunes al balancear ecuaciones químicas y cómo evitarlos
El balanceo de ecuaciones químicas es un proceso crucial en la química, ya que garantiza que se cumpla la ley de conservación de la masa. Sin embargo, muchos estudiantes y químicos novatos cometen errores que pueden llevar a confusiones. A continuación, analizaremos algunos de los errores más comunes y proporcionaremos consejos prácticos para evitarlos.
1. No contar adecuadamente los átomos
Un error frecuente es no contar con precisión la cantidad de átomos de cada elemento en ambos lados de la ecuación. Esto puede llevar a un balance incorrecto. Para evitar este error:
- Realiza una tabla con los elementos involucrados y sus cantidades.
- Compara las cantidades de cada lado de la ecuación.
2. Balancear los elementos en el orden incorrecto
Es esencial balancear primero los elementos que aparecen en una sola molécula antes de pasar a aquellos que están en múltiples compuestos. Si se comienza balanceando los elementos más complejos, se pueden complicar aún más los cálculos. Un enfoque efectivo es:
- Comenzar con los elementos metálicos.
- Seguir con los no metálicos.
- Finalizar con el hidrógeno y el oxígeno.
3. Ignorar los coeficientes
Algunos pueden olvidar que los coeficientes se aplican a todos los elementos en un compuesto. Por ejemplo, en la ecuación:
2H2 + O2 → 2H2O
Aquí, el coeficiente 2 frente a H2 significa que hay un total de 4 átomos de Hidrógeno en el lado de los reactivos, mientras que en el producto sólo hay 2 átomos de Hidrógeno por cada molécula de agua.
4. No verificar el balance final
Una vez que crees haber balanceado la ecuación, es crucial verificar cada elemento nuevamente. A veces, un ajuste en un lado puede desbalancear otro elemento. Utiliza una tabla de verificación para asegurarte de que todo esté correcto.
Estadísticas de errores comunes
Según un estudio realizado por la Asociación Nacional de Química, se estima que hasta un 30% de los estudiantes cometen errores básicos al balancear ecuaciones. Estos errores pueden ser evitados con una práctica constante y un entendimiento claro de los principios detrás del balanceo.
Consejos prácticos
A continuación, algunos consejos prácticos que te ayudarán a balancear ecuaciones químicas de manera más efectiva:
- Practica con ejemplos variados, desde los más simples hasta los más complejos.
- Utiliza software o aplicaciones que ayuden en el balanceo de ecuaciones para verificar tus resultados.
- Siempre revisa las reglas de valencia y las oxidaciones de los elementos.
| Elemento | Reactivos | Productos |
|---|---|---|
| Hidrógeno (H) | 4 | 4 |
| Oxígeno (O) | 2 | 2 |
Al tener en cuenta estos errores comunes y aplicar las recomendaciones ofrecidas, podrás mejorar significativamente tus habilidades en el balanceo de ecuaciones químicas.
Preguntas frecuentes
¿Qué es una ecuación química balanceada?
Es una representación que muestra que la cantidad de átomos de reactivos es igual a la de productos, cumpliendo así la ley de conservación de la masa.
¿Por qué es importante balancear ecuaciones químicas?
Es crucial para asegurar que se cumplen las leyes de la química y para prever los resultados de las reacciones químicas en experimentos y aplicaciones industriales.
¿Cuáles son los pasos para balancear una ecuación química?
Identificar los reactivos y productos, contar los átomos de cada elemento, ajustar los coeficientes y verificar que la cantidad de átomos sea igual en ambos lados.
¿Qué son los coeficientes en una ecuación química?
Son los números que se colocan delante de las fórmulas químicas para indicar cuántas moléculas o moles de cada sustancia participan en la reacción.
¿Se pueden cambiar los subíndices al balancear?
No, los subíndices indican la composición química de una sustancia y no deben ser alterados. Solo se modifican los coeficientes.
Puntos clave sobre el balanceo de ecuaciones químicas
- La conservación de la masa es fundamental para equilibrar ecuaciones.
- Los coeficientes ajustan la cantidad de moléculas involucradas.
- Es importante comenzar balanceando los elementos que aparecen en un solo compuesto.
- Utilizar métodos como el de tanteo o el método de ion-electrón para facilitar el balanceo.
- Siempre verificar el balance final de todos los elementos.
- Practicar con ejemplos diversos mejora la habilidad de balanceo.
¡Dejanos tus comentarios sobre tu experiencia balanceando ecuaciones químicas y no olvides revisar otros artículos de nuestra web que también pueden interesarte!